在血管生物学的早期研究中,通常是将内皮细胞(ECs)平铺在平底表面(如培养皿、多孔膜或图案化的水凝胶表面),通过形成汇合的单细胞层来模拟血管壁。然而,这些2D生物模型并不能很好地模拟体内血管的基本物理结构,即具有圆形截面的三维管腔微结构。微流控技术由于在细胞图案化、化学梯度和机械刺激等方面具有精准的时空调控优势,因此已被广泛应用于体外不同3D生物模型的构建。除此之外,微流控技术允许细胞培养基的持续灌注以提供氧气和营养物质,同时兼有去除代谢废物的功能,这也是实现血管化组织长期培养的必要条件。基于微流控技术,研究人员已提出了诸多三维体外血管构建方法,大致可分为两类:(1)内皮细胞内衬法(EC lining);(2)血管生成(vasculogenesis)和血管新生(angiogenesis)法,本篇将主要介绍基于内皮细胞内衬法的不同构建策略。
内皮细胞内衬法是将ECs粘附在微流通道内壁上,最终形成汇合的单细胞层结构来模拟实现血管管腔,其主要优点在于可以利用微加工技术,实现微血管几何形状和尺寸的灵活设计。此外,根据微流通道尺寸与施加流速大小,研究人员可精确地控制和计算施加在微血管壁上的流体剪切力。然而,由于微流道尺寸限制,很难将高密度的EC均匀分布在直径较小的微流道内,因此内皮细胞内衬法仅适用于构建直径大于50 微米的微血管。通常,中空的微结构(即单通道或多通道网络)是由水凝胶或聚二甲基硅氧烷(PDMS)制成,目前文献报道的成型方法大体可分为四种:1)基于微针的单通道可拆卸法;2)用于单层通道网络的微图案化与平面水凝胶键合方法;3)基于可降解牺牲层的多层通道网络模塑法;4)PDMS微流通道内衬法。尤其对于基于PDMS的内皮细胞内衬法,由于细胞不会紧密粘附在PDMS表面,因此需要在微流道内壁表面涂覆一层薄的基底膜蛋白(例如层粘连蛋白、纤连蛋白、Ⅳ型胶原等),以提高细胞粘附性能。下面将简要介绍几种成型方法的基本操作步骤:
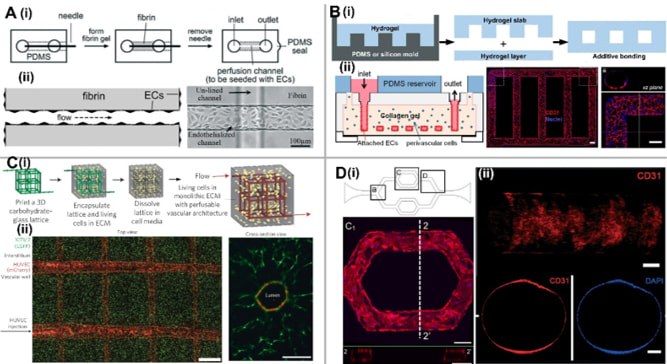
1)微针模塑法:是指将圆柱形物体(如微针、金属丝、玻璃毛细管等)插入水凝胶中,待水凝胶完全聚合后,再将其取出进而形成单个微通道,随后将EC接种到微通道内表面,形成汇合的单层EC(如图1A所示)。此外,除了单层EC,还可以通过平铺平滑肌细胞(SMC)与基底膜蛋白作为细胞粘附层,构建SMC与EC的双层血管结构,这样血管的屏障功能比单层EC更加优异。然而,由于圆柱形物体需要从水凝胶中去除,该方法仅限于建立简单的直线型微血管通道。
2)图案化水凝胶键合法:与单一微流通道不同,单层微流道网络可以通过标准光刻图案化方法制作,例如将带有微图案的胶原凝胶板和平坦凝胶层键合,进而构建了一种相互连接的微血管阵列(如图1B所示)。其基本步骤为:胶原凝胶板从带有微结构的PDMS模具压印而成,并与平坦的胶原基底层键合,形成基于胶原的微通道网络,随后将EC接种于胶原微通道内壁。与基于微针模塑法相比,虽然2D微流通道网络较易制作,但由于光刻得到PDMS模具自身特点,所加工的微流通道网络截面通常是矩形。
3)可溶性牺牲层法:该方法通过溶解或熔化凝胶内的可降解材料,从而制备多层微通道网络。随着3D打印技术的兴起,可使用多种材料来打印更加复杂的多层微通道网络,如碳水化合物类、Pluronic F127、琼脂糖、明胶、海藻酸钠、合成聚乙二醇(PEG)等。图1C所示为基于碳水化合物玻璃所制作了多层微通道网络,并包裹在纤维蛋白凝胶中。当用细胞培养基溶解该玻璃后,纤维蛋白凝胶内便留下三维可灌注、中空、以及圆柱形的网状结构。随后,将EC接种至这些中空的微结构中,便可形成三维血管网络。该方法虽然能够实现复杂的三维微血管网络,但受限于3D打印机的分辨率,也只能制作尺寸较大的血管网络。
4)基于PDMS微流道的EC内衬法:基于PDMS的微流控芯片可实现了直径在60–200 微米之间的单层微通道结构,并且不同的微环境参数(如流速大小、剪切应力等)可利用微流控技术进行精确控制。一般来讲,软光刻技术制备而成的微通道具有固有的矩形或方形截面,不能很好地模拟体内圆形截面的真实微血管。为了解决非圆形截面的问题,可通过在微通道局部固化的水凝胶中,将培养基注入微通道,由于部分水凝胶会留在矩形角处,进而在中心形成圆形流道。类似地,利用液体PDMS或液体硅低聚物等粘性材料,向局部固化的微通道内通入加压气流,也可以制备圆形PDMS微通道,最后通过加热以实现完全固化和后续的EC内衬,如图1D所示。
内皮细胞内衬法是将ECs粘附在微流通道内壁上,最终形成汇合的单细胞层结构来模拟实现血管管腔,其主要优点在于可以利用微加工技术,实现微血管几何形状和尺寸的灵活设计。此外,根据微流通道尺寸与施加流速大小,研究人员可精确地控制和计算施加在微血管壁上的流体剪切力。然而,由于微流道尺寸限制,很难将高密度的EC均匀分布在直径较小的微流道内,因此内皮细胞内衬法仅适用于构建直径大于50 微米的微血管。通常,中空的微结构(即单通道或多通道网络)是由水凝胶或聚二甲基硅氧烷(PDMS)制成,目前文献报道的成型方法大体可分为四种:1)基于微针的单通道可拆卸法;2)用于单层通道网络的微图案化与平面水凝胶键合方法;3)基于可降解牺牲层的多层通道网络模塑法;4)PDMS微流通道内衬法。尤其对于基于PDMS的内皮细胞内衬法,由于细胞不会紧密粘附在PDMS表面,因此需要在微流道内壁表面涂覆一层薄的基底膜蛋白(例如层粘连蛋白、纤连蛋白、Ⅳ型胶原等),以提高细胞粘附性能。下面将简要介绍几种成型方法的基本操作步骤:
1)微针模塑法:是指将圆柱形物体(如微针、金属丝、玻璃毛细管等)插入水凝胶中,待水凝胶完全聚合后,再将其取出进而形成单个微通道,随后将EC接种到微通道内表面,形成汇合的单层EC(如图1A所示)。此外,除了单层EC,还可以通过平铺平滑肌细胞(SMC)与基底膜蛋白作为细胞粘附层,构建SMC与EC的双层血管结构,这样血管的屏障功能比单层EC更加优异。然而,由于圆柱形物体需要从水凝胶中去除,该方法仅限于建立简单的直线型微血管通道。
2)图案化水凝胶键合法:与单一微流通道不同,单层微流道网络可以通过标准光刻图案化方法制作,例如将带有微图案的胶原凝胶板和平坦凝胶层键合,进而构建了一种相互连接的微血管阵列(如图1B所示)。其基本步骤为:胶原凝胶板从带有微结构的PDMS模具压印而成,并与平坦的胶原基底层键合,形成基于胶原的微通道网络,随后将EC接种于胶原微通道内壁。与基于微针模塑法相比,虽然2D微流通道网络较易制作,但由于光刻得到PDMS模具自身特点,所加工的微流通道网络截面通常是矩形。
3)可溶性牺牲层法:该方法通过溶解或熔化凝胶内的可降解材料,从而制备多层微通道网络。随着3D打印技术的兴起,可使用多种材料来打印更加复杂的多层微通道网络,如碳水化合物类、Pluronic F127、琼脂糖、明胶、海藻酸钠、合成聚乙二醇(PEG)等。图1C所示为基于碳水化合物玻璃所制作了多层微通道网络,并包裹在纤维蛋白凝胶中。当用细胞培养基溶解该玻璃后,纤维蛋白凝胶内便留下三维可灌注、中空、以及圆柱形的网状结构。随后,将EC接种至这些中空的微结构中,便可形成三维血管网络。该方法虽然能够实现复杂的三维微血管网络,但受限于3D打印机的分辨率,也只能制作尺寸较大的血管网络。
4)基于PDMS微流道的EC内衬法:基于PDMS的微流控芯片可实现了直径在60–200 微米之间的单层微通道结构,并且不同的微环境参数(如流速大小、剪切应力等)可利用微流控技术进行精确控制。一般来讲,软光刻技术制备而成的微通道具有固有的矩形或方形截面,不能很好地模拟体内圆形截面的真实微血管。为了解决非圆形截面的问题,可通过在微通道局部固化的水凝胶中,将培养基注入微通道,由于部分水凝胶会留在矩形角处,进而在中心形成圆形流道。类似地,利用液体PDMS或液体硅低聚物等粘性材料,向局部固化的微通道内通入加压气流,也可以制备圆形PDMS微通道,最后通过加热以实现完全固化和后续的EC内衬,如图1D所示。